El Agua
Es probable que la vida se haya originado
en el agua, hace más de tres mil millones de años, y que todas las células
vivientes sigan dependiendo del agua para existir. En la mayor parte de las
células el agua es la molécula más importante y forma de 60 a 90% de su masa.
La molécula de agua (H2O) tiene forma de V y el ángulo entre los
dos enlaces covalentes O—H es de 104.5°. Algunas propiedades importantes del
agua se deben a la forma angulada y a los enlaces intermoleculares que puede
formar. Un átomo de oxígeno tiene ocho electrones y su núcleo cuenta con ocho
protones y ocho neutrones.
Una de las consecuencias importantes de la
polaridad de la molécula de agua es que dichas moléculas se atraen entre sí. La
atracción entre uno de los átomos de hidrógeno, ligeramente positivo, de una
molécula de agua y los pares de electrones parcialmente negativos en uno de los
orbitales híbridos sp3,
produce un “puente de hidrógeno”. En un puente
de hidrógeno entre dos
moléculas de agua, el átomo de hidrógeno permanece enlazado covalentemente a su
átomo de oxígeno que es el donador de hidrógeno. Al mismo tiempo, está unido a
otro átomo de oxígeno, llamado aceptor de hidrógeno. El agua no es la única
molécula capaz de formar puentes de hidrógeno; esas interacciones pueden
existir entre cualquier átomo electronegativo y un átomo de hidrógeno unido a
otro átomo electronegativo. Los puentes de hidrógeno son mucho más débiles que los
enlaces covalentes típicos. En los puentes de hidrógeno, la orientación es
importante. Un puente de hidrógeno es más estable cuando el átomo de hidrógeno
y los dos átomos electronegativos asociados a él forman casi una línea recta.
Hay otras dos propiedades del agua que se
relacionan con sus característicos puentes de hidrógeno: su calor específico y
su calor de evaporación. El calor específico de una sustancia es la cantidad de
calor necesario para elevar 1°C la temperatura de 1 gramo de la sustancia. A
esta propiedad también se le llama capacidad calorífica o capacidad térmica.
Las propiedades físicas del agua se
combinan para hacerla un excelente solvente. Ya se estudió que las moléculas de
agua son polares; esta propiedad ejerce consecuencias importantes, como se verá
después. Además, el agua posee una viscosidad intrínseca que no impide mucho el
movimiento de las moléculas disueltas en ella.
El agua puede interactuar y disolver otros compuestos polares y
compuestos que se ionizan. La ionización se relaciona con la ganancia o pérdida
de un electrón, que da lugar a un átomo o a un compuesto que presenta una carga
neta.
Además de sus propiedades físicas, las
propiedades químicas del agua también son importantes en bioquímica, porque las
moléculas de agua pueden reaccionar con moléculas biológicas. A las sustancias
ricas en electrones se les llama nucleófilos (“amantes” del núcleo) porque buscan
especies con carga positiva, o con deficiencia en electrones, llamadas electrófilos (“amantes” del electrón). Los
nucleófilos pueden tener carga negativa o contar con pares no compartidos de
electrones. Los átomos nucleófilos más comunes en biología son de oxígeno,
nitrógeno, azufre y carbono.
Una de las propiedades importantes del
agua es su pequeña tendencia a ionizarse. El agua pura no está formada sólo por
H2O, sino también por una baja concentración de iones hidronio (H3O_) y una
concentración igual de iones hidróxido (OH_).
La ionización del agua se puede
representar entonces como una disociación simple de un protón a partir de una
sola molécula de agua. Los iones hidróxido pueden aceptar un protón y
convertirse de nuevo en moléculas de agua.
La ionización del agua se puede analizar
cuantitativamente. Recuérdese que las concentraciones de reactivos y productos
en una reacción deben llegar al equilibrio. La relación de esas concentraciones
define a la constante de equilibrio (Keq). En el caso de a ionización
del agua
Los ácidos y bases que se disocian por
completo en agua, como el ácido clorhídrico y el hidróxido de sodio, se llaman
ácidos fuertes y bases fuertes. Hay muchos otros ácidos y bases, como por
ejemplo los aminoácidos que forman las proteínas y las purinas y pirimidinas
del ADN y ARN, que no se disocian por completo en el agua. A dichas sustancias
se les conoce como ácidos débiles y bases débiles.
El ion cloruro es la base que corresponde
al HCl después que cede su protón. Al Cl_ se
le llama la base conjugada del HCl, lo que indica que es una
base, es decir, que puede aceptar un protón, y es parte de un par ácido base
(es decir, HCl/Cl_). De igual modo, el H3O_ es
el ácido en el lado derecho del equilibrio porque puede donar un protón. H3O_ es el ácido conjugado del H2O.
Aminoácidos
Los Aminoácidos están formados
por un grupo Carboxilo y uno amino
Estructura general
de los aminoácidos
Todos los organismos
emplean los mismos 20 aminoácidos como bloques constructivos para armar
las moléculas de proteína. A
estos 20 aminoácidos se les llama aminoácidos comunes, estándar o
normales. A pesar de la poca cantidad de los aminoácidos, se
puede obtener una variedad enorme de distintos polipéptidos al unir los 20
aminoácidos comunes para formar distintas combinaciones.
Los aminoácidos se llaman así porque son derivados aminados de ácidos
carboxílicos.
 En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos
al mismo átomo de carbono: el átomo de carbono a. Así, todos los
aminoácidos estándar que contienen las proteínas son a-aminoácidos.
En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos
al mismo átomo de carbono: el átomo de carbono a. Así, todos los
aminoácidos estándar que contienen las proteínas son a-aminoácidos.
Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno
y una cadena lateral (R) que es única para cada aminoácido. En los nombres
químicos de los aminoácidos, los átomos de carbono se identifican con
números que comienzan en el átomo de carbono del grupo carboxilo.
Es probable que las primeras proteínas estuvieran formadas por una
pequeña cantidad
de aminoácidos simples, y la selección de aminoácidos L frente a
aminoácidos D
fuera un evento aleatorio. Los organismos vivos modernos no seleccionan
aminoácidos
L de una mezcla ya que sólo sintetizan aminoácidos L en cantidades
suficientes. Así, el
predominio de aminoácidos L en las especies modernas se debe a la
evolución de las rutas
metabólicas que producen aminoácidos L y no aminoácidos D
A. Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo
de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral.
Los dos átomos
de hidrógeno del carbono a de la glicina imparten poco carácter
hidrofóbico a la molécula.
Después habrá oportunidad de comprobar que la glicina desempeña un papel
único en la
estructura de muchas proteínas porque su cadena lateral es lo bastante
pequeña como para
tener cabida en nichos en los que a otros aminoácidos les resultaría
imposible hacerlo.
Hay cuatro aminoácidos: alanina (Ala, A), valina (Val, V), leucina (Leu,
L) y el isómero estructural de la leucina, isoleucina (Ile, I), que tienen
cadenas laterales alifáticas saturadas. La cadena lateral de la alanina es un
grupo metilo, mientras que la valina presenta una cadena lateral ramificada con
tres carbonos, y la leucina y la isoleucina contienen una cadena lateral
ramificada de cuatro carbonos cada una. Los átomos de carbono a y b de la
isoleucina son asimétricos. Ya que la isoleucina tiene dos centros quirales,
posee cuatro estereoisómeros posibles
B. Grupos R aromáticos
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W)
presentan cadenas laterales con
grupos aromáticos. En el caso de la fenilalanina es una cadena hidrofóbica
bencílica. La tirosina se parece estructuralmente a la fenilalanina; en
la tirosina, un grupo
C. Grupos R sulfurados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos
azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su
cadena lateral, lo que la convierte en uno de los aminoácidos más
hidrofóbicos. La metionina desempeña un papel especial en la síntesis de
proteínas porque casi siempre representa el primer aminoácido en una cadena de
polipéptido. La estructura de la cisteína se parece a la de la alanina, con un
átomo de hidrógeno reemplazado por un grupo sulfhidrilo
D. Grupos R básicos
E. Grupos R ácidos y sus amidas derivadas
Peptidos
Son cadenas de aminoácidos
El enlace peptidico: Unión de dos aminoácidos
- Enlace covalente
tipo amida
- Reacción de
condensación
- Se elimina H2O
- La unión de dos aa
da lugar a un dipeptidos
El oxigeno del carbonilo tiene una carga negativa parcial y el nitrógeno
de la amida una carga parcial positiva, la creación de un pequeño dipolo
eléctrico.
La
conformacion trans del enlace peptidicos
El enlace peptidico presenta usualmente conformación trans del oxigeno
del carbonilo con respecto al hidrogeno de la amida
El
enlace peptidico es plano y rígido
- Los
enlaces peptidicos no pueden rotar libremente
- El
esqueleto de la cadena polipeptidica es una seria de
planos rígidos que comparten
un punto común de rotación.

Reacción del
grupo amino
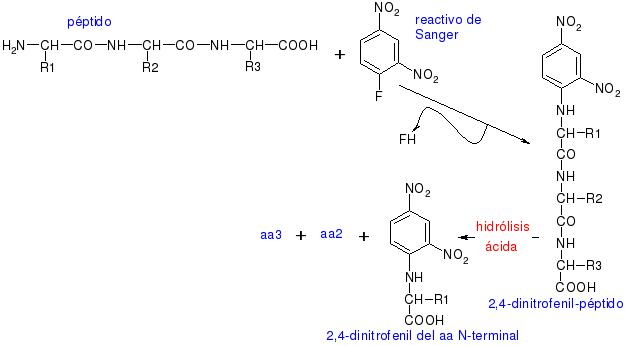
es muy interesante la reacción con el reactivo de Sanger para
secuenciar, ya que si tenemos el 2,4-dinitrofenil-péptido y lo hidrolizamos por
hidrólisis ácida, se hidrolizarán todos los enlaces peptídicos y obtendremos el
dinitrofenil del primer aminoácido de la secuencia, el –NH2 terminal,
más el resto de los aminoácidos disgregados en el medio.
Con esta reacción Sanger consiguió secuenciar la insulina.
En esta reacción, el núcleo coloreado de dinitrobenceno se une al átomo
de nitrógeno del aminoácido para producir un derivado amarillo, el derivado
2,4-dinitrofenil o DNP-aminoácido. El compuesto DNFB reaccionara con el grupo
amino libre del extremo amino de un polipéptido, así como también con los
grupos amino de los aminoácidos libres. El enlace C–N que se forma es por lo
general mucho más estable que un enlace peptídico. De esta forma, haciendo
reaccionar una proteína nativa o un polipéptido intacto con el DNFB,
hidrolizando la proteína en ácido y aislando los DNP-aminoácidos coloreados,
puede identificarse el grupo amino terminal del aminoácido en una cadena polipeptídica.
El grupo amino terminal de la lisina y algunos otros grupos funcionales de las
cadenas laterales también reaccionarán con el DNFB.
Sin embargo, después de la hidrólisis, solo el derivado del grupo amino
terminal del aminoácido original tendrá su grupo α-amino bloqueado; asimismo,
tales DNP-α-aminoácidos pueden separarse de otros derivados DNP mediante
procedimientos de extracción simples. Con cualquiera de los variados métodos
cromatográficos se podrá identificar a los DNP-α-aminoácidos
Pero este proceso consume mucha
energía, ya que, teniendo el primer aminoácido hay que obtener los demás
rompiendo por otras zonas. Esto se evita con la degradación de Edman (también
es una reacción de aminoácidos): Como la ciclación se da en condiciones ácidas
suaves, no se rompen los enlaces, y se da la feniltiohidantoína del aminoácido
–NH2 terminal y queda
el resto del péptido intacto.

Proteínas
Los prótidos o
proteínas son biopolímeros, están formadas por un gran número de unidades
estructurales simples repetitivas (monómeros) denominado aminoácidos,
unidas por enlaces peptídicos. Debido a su gran tamaño, cuando estas
moléculas se dispersan en un disolvente adecuado, forman siempre dispersiones
coloidales, con características que las diferencian de las disoluciones de
moléculas más pequeñas. Muchas proteínas presentan carga neta en ciertos rangos
de pH del medio. Por ello pueden considerarseionómeros.
Por hidrólisis, las moléculas de proteína se dividen en numerosos compuestos relativamente simples, de masa molecular pequeña, que son las unidades fundamentales constituyentes de la macromolécula. Estas unidades son los aminoácidos, de los cuales existen veinte especies diferentes y que se unen entre sí mediante enlaces peptídicos. Cientos y miles de estos aminoácidos pueden participar en la formación de la gran molécula polimérica de una proteína.
Todas las
proteínas tienen carbono, hidrógeno, oxígeno y nitrógeno,
y casi todas poseen también azufre. Si bien hay ligeras variaciones en
diferentes proteínas, el contenido denitrógeno representa, por término
medio, 16 % de la masa total de la molécula; es decir, cada
6,25 g de proteína contienen 1 g de N. El factor 6,25 se utiliza para
estimar la cantidad de proteína existente en una muestra a partir de la
medición de N de la misma.
La síntesis
proteica es un proceso complejo cumplido por las células según las
directrices de la información suministrada por los genes.
Las proteínas
son largas cadenas de aminoácidos unidas por enlaces peptídicos entre el grupo
carboxilo (-COOH) y el grupo amino (-NH2) de residuos de
aminoácido adyacentes. La secuencia de aminoácidos en una proteína está
codificada en su gen (una porción de ADN) mediante el código genético
Las proteinas se dividen en estructuras
- Estructura Primaria: Secuencia de aminoácidos en el
polipeptido.
- Estructura Secundaria: Arreglo espacial local de los átomos de
la cadena
del polipeptido
- Estructura terciaria: Estructura tridimensional de todo el
polipeptido
- Estructura Cuaternaria: Arreglo espacial de las subunidades
de proteica compuesta
por múltiples polipeptidos.

Los polipeptidos se pueden separar y purificar
Tipos de
cromatografias:

- Cromatografia en columna
- Cromatografia de intercambio ionico
- Cromatografia de exclusion por tamaño
- Cromatografia de afinidad
La composición de aminoácidos de
las proteínas se pueden determinar cuantitativa mente